
甲基苯丙胺对瞬时外向钾电流影响
摘要:目的观察甲基苯丙胺(Meth)对瞬时外向钾电流的影响及原因。方法将怀孕18dSD大鼠胎鼠海马神经元分为对照组和Meth处理组,利用全细胞膜片钳方法记录外向瞬时钾电流变化;采用原位末端转移酶标记技术(TUNEL)观察Meth引起的细胞损伤作用;利用逆转录聚合酶链反应(RT-PCR)方法观察瞬时外向电流成分中Kv1.4、4.1、4.2和4.3表达,并通过western-blot方法观察Kv4.2蛋白表达。结果与对照组[(87.4±12.5)pA/pF]比较,Meth能引起瞬时外向钾电流增大[(120.1±19.6)pA/pF](P<0.01),与对照组(1.00±0.18)比较,Meth处理组凋亡率为对照组的(7.11±0.95)倍(P<0.01),钾通道抑制剂4-氨基吡啶(4-AP)明显抑制神经元凋亡(P<0.01);Kv4.2可能是外向电流成分中主要贡献者,Meth能上调Kv4.2通道蛋白表达;与Kv4.2上调密切相关的Kchip2/3、Kchip4、CaMK2蛋白表达增高。结论Meth引起的瞬时钾电流增大可能通过Kv4.2上调来实现,但其机制仍需进一步探讨。
甲基苯丙胺(Meth)俗称冰毒,是目前最为常见的精神兴奋剂之一,全世界约有1500~1600万使用者,仅次于大麻,Meth滥用已经成为国际重大公共卫生问题[1]。Meth滥用可引起一系列负面作用[2],研究表明,Meth可引起神经退行性改变[3]。尽管目前Meth毒性及其机制已经部分明确,但大多数研究仍集中于对多巴胺能和血清素能神经元探讨。而Meth造成皮层灰质、海马神经元损伤机制仍然不明。研究发现,Meth使用者脑形态发生明显变化,尤其是海马发生明显收缩[4]。而电压依赖性钾通道(Kv)对维持细胞体积,介导细胞凋亡起重要作用[5],因此,基于Meth可引起海马形态学变化及钾离子在细胞体积维持中作用,本研究采用怀孕18dSD大鼠胎鼠海马神经元,观察甲基苯丙胺(Meth)对瞬时外向钾电流影响及原因,结果报告如下。
1材料与方法
1.1主要试剂与仪器清洁级怀孕18dSD大鼠(南京医科大学实验动物中心),许可证号:SYXK(苏)2008-0007,以胎鼠海马神经元为研究对象。兔抗微管相关蛋白2(microtubule associated protein-2,MAP-2)(美国Invitrogen公司),兔抗Kv4.2(美国chemicon公司),小鼠抗pan-KChIP(美国NeuroMab公司),兔抗CaMK2抗体(美国abcam公司),methamphetamine、小鼠抗β-actin(美国Sigma公司),原位末端转移酶标记(TdT-mediated dUTP nick end labeling,TUNEL)试剂盒(美国Roche公司),无血清培养液、B27(美国Gibco公司)。电极制备:记录用的微电极用硼化玻璃毛细管(内径1.6mm,美国WPI公司)经微电极二步拉制仪(美国Sutter公司)两步拉制而成。充灌内液后,电极电阻阻抗为3~6MΩ。
1.2海马神经元分离取出海马组织,剪碎,用0.25%蛋白胰酶,同时加入100μL的DNAse消化,15~20min后,以胎牛血清中和,吹打细胞,离心;加入汉克平衡盐缓冲液(hank sbalanced salt solution,HBSS),吹打分离,先后经100、40μm网筛过滤。离心,弃上清,加入细胞培养液,吹打使细胞悬浮。计数,以适当密度接种于培养皿中,每3d细胞换液。细胞以抗神经元特异性抗体MAP-2进行鉴定。
1.3全细胞膜片钳记录采用全细胞电压钳记录模式,给予细胞一组从-80mV至+80mV、以20mV递增的去极化刺激方波,持续时间为200ms,引出4-AP敏感型电流。利用AXON1440A数模转换器对信号进行收集,采集和滤波频率分别为5和1kHz,所记录电流经放大器放大后,采集储存于计算机中。系统电阻、漏电流和电容电流由手动补偿,慢电容补偿率75%~80%。所有记录均在室温(21±2)℃下完成。
1.4TUNEL实验检测细胞凋亡实验步骤参照试剂盒说明。凋亡细胞呈现绿染,4',6-联脒-2-苯基吲哚二盐酸盐(4'-6-diamidino-2-phenglindole,DAPI)染核呈蓝色,荧光显微镜在400倍下,各处理组随机选取10个视野,平行双样,重复3次,计算各处理组凋亡率=绿染细胞数/DAPI蓝染细胞总数×100%,将对照组细胞凋亡率标化为1,进行各组间细胞凋亡比较。
1.5Kv1.4、4.1、4.2、4.3表达采用逆转录聚合酶链反应(RT-PCR)法,引物序列如下:Kv1.4:上游5'-CCATACCTACCTTCTAAT-3',下游5'-TCACACATCAGTCTCCAC-3'。Kv4.1:上游5'-TCACAGGGAAGAGATCTTGA-3',下游5'-ACTAGCGGGTCTTCGGAGGA-3'。Kv4.2:上游5'-CCGAATCCCAAATGCCAATGTG-3',下游5'-CCTGACGATGTTTCCTCCCGAATA-3'。Kv4.3:上游5'-GCAAGCGCAATGGACTCCTCAA-3',下游5'-GAAGGGCTTCTGGTGGATGGGTAG-3'。GAPDH:上游5'-TCAAGAAGGTGGTGAAGCAG-3',下游5'-AGGTGGAAGAATGGGAGTTG-3'。反应程序如下:94℃预变性5min,28个循环,94℃变性30s,60℃退火45s,72℃延伸60s,10min72℃末次延伸。对于Kv1.4,退火温度设为52℃,其余相同。
1.6Western-blot检测Kv4.2表达海马神经元经Meth处理后,提取总蛋白,蛋白上样量为10μg,电泳,转膜,一抗4℃过夜。二抗孵育1h,化学发光液显色,曝光。灰度以ImageJ软件进行分析。
1.7统计分析所有数据以珋x±s表示,由Clamfit10、Origin8和SigmaPlot软件分析处理,应用单因素方差分析或t检验进行统计学分析,P<0.05为差异有统计学意义。
2结果
2.1Meth对瞬时外向钾电流影响(图1)电生理结果显示,对照组和Meth处理组(图1B)4-氨基吡啶(4-aminopyridine,4-AP)敏感型钾电流分别为(87.4±12.5)PA/PF(n=10)和(120.1±19.6)pA/pF(n=7),与对照组比较(图1A),Meth组明显增大(t=-4.901,P<0.01)。
2.2Meth对海马神经元凋亡作用细胞与1000μmol/LMeth共同孵育48h,然后利用TUNEL的方法观察神经元凋亡。Meth处理组与对照组(1.00±0.18)比较,细胞凋亡率为对照组的(7.11±0.95)倍(P<0.01)。与Meth处理组比较,钾通道抑制剂4-AP(1mmol/L)干预组(4.96±1.32)细胞凋亡明显降低(F=67.495,P<0.01)。
2.3瞬时外向钾电流主要成分在海马神经元中表达(图2)结果显示,Kv4.2mRNA表达较其余3种亚型钾通道为高,图2B为内参GAPDH表达条带。
2.4Meth对Kv4.2蛋白表达影响(图3)细胞与100μmol/LMeth分别孵育4、16h后,Kv4.2表达明显增高(图3A)。同时明显上调KchiP家族中KchiP2、KchiP3/4(图3C)以及CaMK2(图3B)表达,而KchiP1条带则没有明显变化。
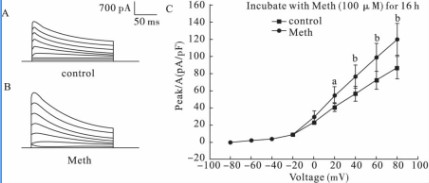
注:A、B:分别为对照组、Meth处理组瞬时外向钾电流;C:瞬时外向钾电流密度I-V曲线(aP<0.05,bP<0.01)。
图1Meth孵育16h对瞬时外向钾电流影响
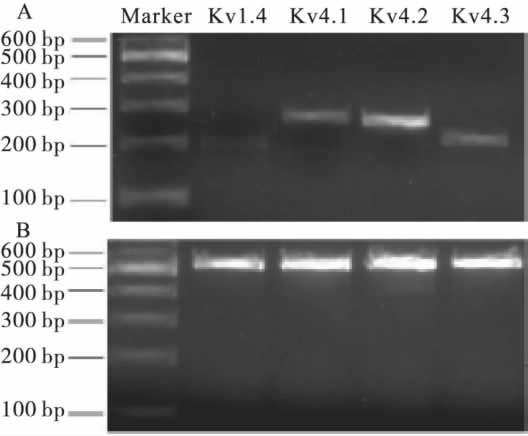
注:A:Kv1.4、4.1、4.2和4.3mRNA表达条带;B:GAPDH表达条带。
图2海马神经元中主要瞬时外向钾通道表达注:A:Kv4.2蛋白表达;B:CaMK2表达;C:Kchip1、2、3、4蛋白表达;D:β-actin表达。
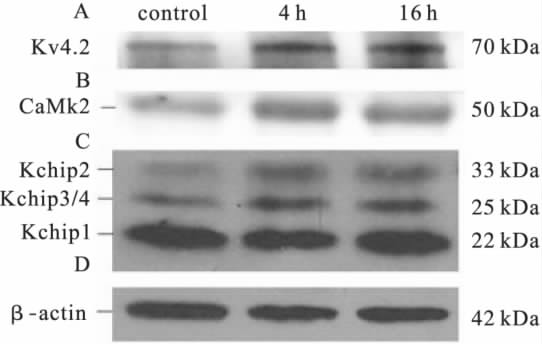
图3Meth对海马神经元中Kv4.2及KchiPsCaMK2蛋白表达影响
3讨论
外向钾电流主要包含2种电流成分即瞬时外向和延迟整流型成分,前者可被4-AP拮抗,称为4-AP敏感型钾电流,后者可被四乙胺(tetraethylamine,TEA)阻断,称为TEA敏感型钾电流。在外液中加入20mM/LTEA,可对4-AP敏感型电流进行记录。本研究结果显示,Meth明显增大瞬时外向钾电流,抑制剂4-AP则明显抑制由Meth引起的神经元损伤,提示4-AP敏感型钾通道可能是Meth引起海马神经元损伤靶点之一。海马神经元中存在Kv1.4、4.1、4.2、4.3等多种瞬时外向成分。其中Kv4.2在调节神经元兴奋中及可塑性过程中起重要作用[6]。本研究结果亦表明Kv4.2在海马神经元中表达最为丰富,提示Kv4.2可能在Meth引起的细胞损伤中起作用。此外,Meth与细胞作用4、16h后明显上调海马神经元中Kv4.2表达,这一现象与电生理实验中Meth引起瞬时外向电流增大结果一致。最近,有研究指出,在海马神经元中,Kv4.2表达和CaMK2以及KchiP家族蛋白表达相关[7-8]。前者上调可引起Kv4.2表达增高,后者KchiP家族蛋白中,Kchip2、Kchip3/4与Kv4.2共定位于海马神经元中,在Kv4.2由胞浆向胞膜转移过程中起关键作用[8]。本研究结果表明,Meth作用神经元后,CaMK2和Kchip2、Kchip3/4表达均增高,提示Meth可能一方面通过CaMK2促进Kv4.2高表达,另一方面通过上调Kchip2、Kchip3/4促进Kv4.2向胞膜上转移,引起电流增大。


文章评论