
【摘要】目的对尿液和血液中海洛因代谢物3-β -D -葡萄糖醛酸吗啡(M3G),吗啡,O6—单乙酰吗啡O6)在180d内的稳定性进行研究。方法准备空白添加血液、尿液、染毒动物失白兔)血液、尿液和吸食海洛因者血液、尿液样本,分别置于20℃、4℃、- 20℃下,分别于O、1、2、4、7、14、28、56、112、156、180d时间点测定样品中M3G、吗啡,O6相对含量。结果在3种不同温度下,随保存时间的延长,血液、尿液中的O6含量均逐渐下降至零;血液中吗啡含量升高(空白血液添加组)或下降染毒动物组),在尿液则均升高;血液样中M3G含量均升高,尿样中则略有下降。下降和升高的幅度均随保存温度的下降而缩小。结论海洛因代谢物在- 20℃时保存稳定性最佳。
在法庭毒物分析中,因样品从采集到检测的时间或保存方式的差别,可能造成检测结果发生偏差。目前的国内已有血液和尿液样品中部分药品和毒物代谢稳定性的研究报道,但未见有关海洛因相关研究的文献。本文对海洛因代谢物3-β-D-D萄糖醛酸吗啡(M3G),吗啡,O6.单乙酰吗啡O6 -monoacetylmorphine,O6)在血液和尿液中的稳定性进行研究,希望能为司法鉴定中同一检材多次检验结果不同的解释提供依据。
1 材料与方法
1.1 主要仪器、试剂和样本
主要器材 UFLC(LC-20A)液相色谱仪岛津公司,日本);API4000 QTrap三重四级杆系统(AB公司,美国),固相萃取装置(J.T.Baker,美国)。C18固相萃取柱:BAKERBONDTM spe Octadecyl (C18) DisposableExtraction Columns 3cc 500mg (J.T.Baker,美国)。
标准品 吗啡(1mg/mL),O6 (1mg/mL),M3G(1OO μg/mL),氘代O6-单乙酰吗啡O6-d3,1mg/mL)均购自美国Cerilliant公司;72. 7%海洛因粉末(日常案件缴获)。
实验样本及动物 健康人尿液(北京309医院体检中心提供);海洛因阳性尿液4份公安局送检并经定性的海洛吸食者尿液)。日本纯种雄性大耳兔(北京大学医学部实验动物中心提供);
1.2标准溶液配制
①混合标准工作液:取吗啡、M3G、O6标准液,用甲醇稀释为混合浓度为1 μg/mL、2μg/mL的混合标准工作液。②内标工作液:取O6-d,标准品,用甲醇稀释为1 μg/mL的内标工作液。
1.3 样品制备
空白血液添加组实验兔3只隔夜禁食,经颈动脉插管取血混匀。取具塞试管若干,分别加入0. 3mL血液、0. 1mL 1μg/mL混合标准工作液,混匀后分别放置于20℃、4℃、- 20°C下,于0、1、2、4、7、14、28、56、112、156、180d时间点检测吗啡、M3G、O6含量的变化(20℃下检测至14d),每个温度每个时间点平行实验3次,结果取平均值。
染毒动物组 实验兔5只隔夜禁食,耳缘静脉注射Smg/kg海洛因生理盐水,3h后颈动脉插管,负压真空管采血(A组3只混匀为1份、B、C组各1只)。取具塞试管若干,分别加入0. 4mL血液,放置温度、检测项目及时间同点同空白血液添加组,A组每个温度每个时间点平行实验3次,结果取平均值;B、C组各1份样品。
空白尿液添加组 取具塞试管若干,分别加入0. 8mL健康人尿液、0.1mL 2μg/mL混合标准工作液混匀,放置温度、检测项目及时间同空白血液添加组,其中20℃下检测至28d,每个温度每个时间点平行实验3次,结果取平均值。
吸食海洛因者尿液组取海洛因阳性尿液4份A、B、C、D组)。取具塞试管若干,分别加入0. 045mL尿液、0.855mL去离子水混匀,放置温度、检测项目及时间空白血液添加组,其中20 0C下检测至28d,A组每个温度每个时间点平行实验3次,结果取平均值,B、C、D组各1份样品。
1.4 空白血液、尿液添加样品的预处理
取内置血液和尿液样品试管,加入内标工作液0. 1mL,涡旋3min;加入1mL 5mmol/L碳酸铵缓冲液,涡旋3min;4 000r/min离心3min后,血液取上清液、尿液取全部作为待过柱液A,再向离心管内加入ImL0. 5mol/L碳酸铵缓冲液,涡旋3min,4 000r/min离心3min,血液取上清液、尿液取全部作为待过柱液B。
1.5 血液、尿液样品提取净化方法
取Cls固相萃取柱,依次加3mL甲醇,3mL去离子水,2mL 0.5mol/L碳酸铵缓冲液活化;加先后入待过柱液A、B过柱锍速Iml/min);ImL 5mmoL/L碳酸铵缓冲液淋洗,氮气吹干5 min;加入2mL 70%乙腈水溶液洗脱,洗脱液在45℃下用氮气吹干,100 μL甲醇定容,按血液1:5、尿液1:10甲醇稀释后取5μL进样进行LC -MS/MS检测。
1.6 检测条件
液相色谱条件 Atalantis@ HILIC Silica液相柱Q.Imm×150mm×3μm),前接phenomenex保护柱OIKMA公司,美国),柱温40℃;流速500 μL/min,采集时间8.5 min。
质谱条件 采用电喷雾电离_正离子模式MRM检测,操作参数GS1:50;GS2:50;气帘气CUR):25;碰撞气(CAD):Medium;离子喷雾电压:5 500V;温度:5500C。M3G、吗啡、O6、O6-d,特征定量离子对Q1/Q3分别为:462. 2/286.1、286. 1/165.1、328.2 /165.0、331.2/165.1;保留时间:5.08、4.67、4.58、4.59 min。
流动相条件 A:0.1%甲酸-1Ommol/L甲酸铵溶液(PH 4);B:0.1%甲酸—乙腈溶液。梯度洗脱方式:A:5%、45%、45%、5%:B:95%、55%、55%、95%.时间:1.5、3.0、6.0、6.1min,8.5min终止。
2结果与讨论
将不同温度、不同保存时间下检测得到的数据用Analystl.5.2软件处理,得到血液和尿液空白添加、染毒动物血液和尿液样品、吸食海洛因者血液和尿液样品中不同温度下各时间点吗啡、M3G、O6组分的含量,结果以组分间相对含量百分比形式表示,详见表1—3。
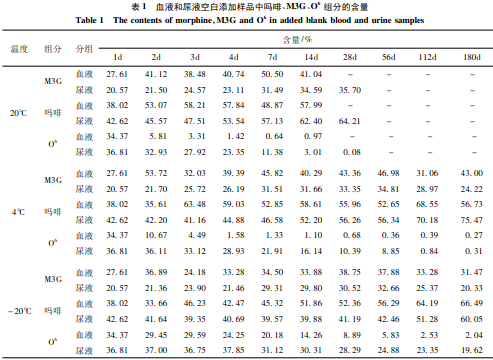
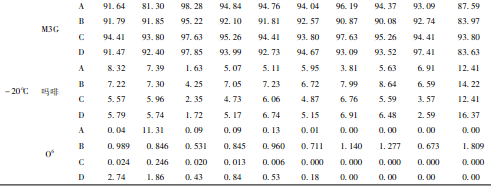
从表1可见,随保存时间的延长,空白添加血样在20℃,4℃,- 20℃3种温度下,O6相对含量均逐渐下降,直至近零,而吗啡和M3G含量均上升。空白添加尿样,在20℃和4℃时,O6含量逐渐下降,吗啡含量则较快上升,M3G含量也略有上升;但在- 20℃时,O6含量下降趋势见缓,至180d下降近一半,吗啡含量则缓慢上升,而M3G含量则基本保持不变。
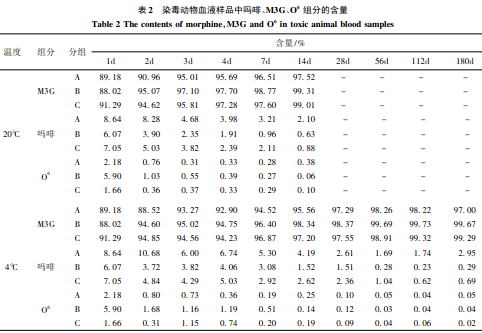
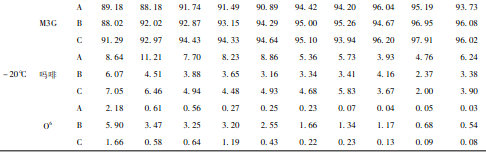
从表2可见,随保存时间延长,染毒动物血样在3种温度下,O6含量均逐渐下降,直至为零,吗啡含量也下降,但- 20℃时,下降速度最慢,而M3G含量则呈上升趋势,同样于- 20℃时,上升速度最慢。
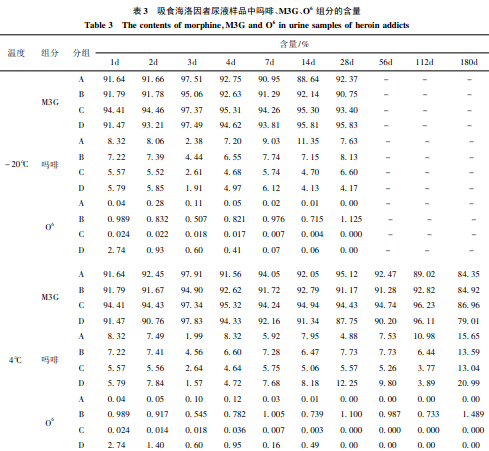
从表3可见,因长期吸食海洛因,吸毒者尿液中M3G含量均非常高,吗啡含量次之,O6含量最低。在3种温度下,O6含量逐渐下降至零;吗啡含量略有下降,M3G含量则略有上升。
上述实验结果表明,血液和尿液中海洛因主要代谢物(MI3G、吗啡、O6)在180d期间内稳定性较好;3种保存温度中- 20℃时稳定性最好。其中O6是甄别吸食海洛因的重要依据,因在吸食者的尿液中含量较低,室温下应在7d内检测,- 20℃可延至1个月。
从本文检测结果推测(表1),海洛因主要代谢物间存在两种变化,一是O6降解成吗啡,二是吗啡与样品中蛋白结合成M3G,而这两种变化有以下特点:
①变化趋势均随温度的升高而明显。
②O6降解成吗啡的变化趋势在血液和尿液中存在差异。在4℃时,血中O6至7—14d内基本降解完全,而一20℃时直到180d才基本降解;尿中O6在4℃时,保存到28d降解约3/4,在- 20℃时,到180d降解近一半,这可能与血、尿中含有的活性物质有关。
③吗啡与样品中蛋白结合成M3G的变化趋势在血和尿样中也存在差异性(表2、3)。在20℃时,染毒动物血样中吗啡在28d大部转化为M3G,而尿样中吗啡含量在相同时段下降不到10%;在- 20℃时,保存到180d,约一半的吗啡转化为M3G,而尿样中吗啡和M3G的相对含量基本没有变化。空白添加样品中,吗啡转化成M3G的速度亦明显低于O6降解成吗啡的速度。这可能与血液比尿液中含有更多的蛋白和脂肪类物质有关。
本文实验仅观察了180d内血和尿样中海洛因代谢物M3G、吗啡、O6的变化规律,但尚不能准确解释其转化机制,还需进一步的研究证实。


文章评论